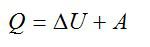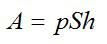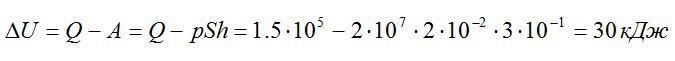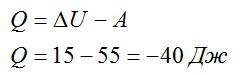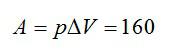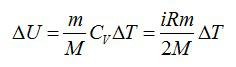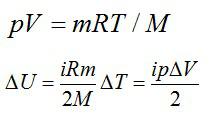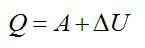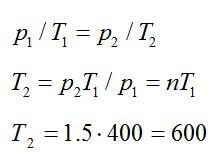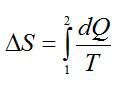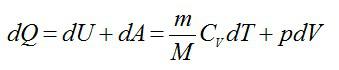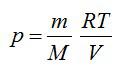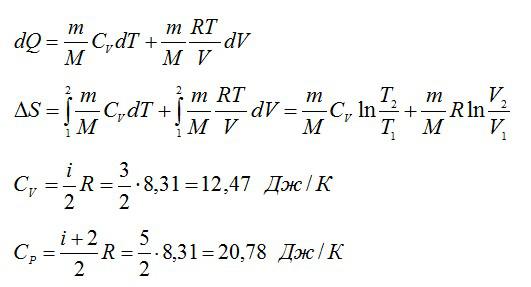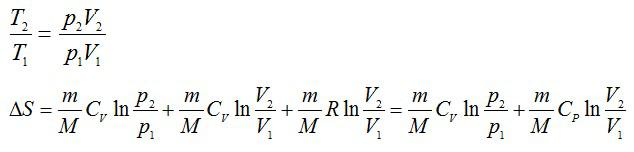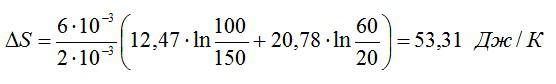Задачи на внутреннюю энергию или работу идеального газа определить достаточно просто: в задаче в качестве дано или найти присутствуют эти параметры. Соответственно для решения необходимо знание формул для работы идеального газа и его внутренней энергии. Часто помогает и уравнение Менделеева-Клапейрона.
Важно: не стоит забывать, что температура в разделе термодинамика и молекулярная физике обязательно должна иметь размерность кельвин:
Первый закон, или первое начало термодинамики является частным случаем закона сохранения энергии. Разберемся, как он работает, с помощью решения простых задач.
Подписывайтесь на наш телеграм-канал, чтобы не только легко решать задачи, но и узнавать лайфхаки для любых жизненных ситуаций.
Первый закон термодинамики: решение задач
Алгоритм решения задач на первый закон термодинамики ничем не отличается от алгоритма решения любой другой физической задачи. С ним вы можете ознакомиться, открыв нашу универсальную памятку. Также полезно будет держать под рукой формулы, которые часто используются при решении задач.
Задача №1. Применение первого закона термодинамики
Условие
Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели, сообщив ему количество теплоты в 1,5*10^5 Дж, поршень сдвинулся на расстояние h=30 см. Как изменилась внутренняя энергия газа, если его давление осталось равным 2*10^7 Па.
Решение
Запишем первое начало термодинамики:
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
Ответ: 30 кДж.
Задача №2. Применение первого закона термодинамики
Условие
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Решение
Записываем первое начало термодинамики и подставляем значения:
A пишется со знаком «минус», так как это работа внешних сил над газом, а не наоборот.
Ответ: в процессе газ отдал 40 Дж теплоты.
Задача №3. Расчет работы, изменения внутренней энергии и количества теплоты
Условие
Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров. Определить изменение внутренней энергии кислорода, работу, совершенную газом, и количество теплоты, сообщенное ему.
Решение
Изменение внутренней энергии равно:
Используем уравнение состояния газа:
Число степеней свободы i для двухатомной молекулы равно 5.
Согласно первому закону термодинамики, сообщенное газу тепло равно:
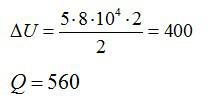
Ответ: А=160 кДж, ∆U=400 кДж, Q=560 кДж.
Задача №4. Изопроцессы
Условие
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Решение
Так как нагревание газа происходит при постоянном объеме, процесс – изохорный. При изохорном процессе:
Ответ: 600 К.
Задача №5. Расчет изменения энтропии
Условие
Найти изменение ∆S энтропии при расширении массы m = 6 г гелия от объема V1 = 20 л под давлением р1 = 150 кПа к объему V2 = 60 л под давлением р2 = 100 кПа.
Решение
Изменение энтропии при переходе вещества из состояния 1 в состояние 2:
Согласно первому началу термодинамики:
Из уравнения Менделеева-Клапейрона выразим давление:
Из уравнения Менделеева-Клапейрона:
Ответ: ∆S=53,31 Дж/К.
Кстати! Для наших читателей действует скидка 10% на любой вид работы.
Вопросы по теме «1-ый закон термодинамики»
Вопрос 1. Приведите пример действия первого закона термодинамики.
Ответ. В качестве примера можно привести газ в сосуде. Если сообщить ему какое-то количество теплоты, оно пойдет на увеличение внутренней энергии газа в сосуде.
Вопрос 2. Сформулируйте первый закон термодинамики.
Ответ. В любой изолированной системе запас энергии остается постоянным.
Вопрос 3. Как еще можно сформулировать первый закон термодинамики?
Ответ. Вот разные формулировки первого закона термодинамики:
- Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
- Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Вопрос 4. Что такое изопроцесс? Какие есть изопроцессы?
Ответ. По определению:
Изопроцесс – это термодинамический процесс, при котором один из параметров системы (давление, объем, температура, энтропия) остается неизменным.
Изопроцесс может быть:
- изотермическим (T=const);
- изобарным (P=const);
- изохорным (V=const);
- Адиабатическим (отсутствует теплообмен с окружающей средой).
Вопрос 5. При каком изопроцессе газ не совершает работу?
Ответ. При изохорном.
Ищете, где почитать теорию по теме, а учебника нет под рукой? Далеко ходить на надо, почитайте наш отдельный материал по первому началу термодинамики. А если при решении заданий понадобится помощь, обращайтесь в профессиональный студенческий сервис.
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода.
Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода. Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Поясните,почему умножение идет 2х10^5 ,когда газ совершает работу от 1 до 2, вроде должно быть 1х10^5,а по ответу получается от 0 до 2.
На участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется. Вся работа совершается на участке 2-3. Общее правило следующее, если процесс изображен на диаграмме , то работа равна площади под графиком со знаком плюс, если объем увеличивается, и со знаком минус, если уменьшается. Для тепловой машины, работающей по циклу, полезная работа равна площади ограниченной этим циклом, это укладывается в ранее озвученное правило. Когда мы идем по "верхней" части цикла, работа идет в +, потом возвращаемся по "нижней" в исходную точку, работа теперь идет в -, в результате остается только кусок внутри.
Алексей, вот Вы сказали, что "на участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется."
а на участке 2-3 ведь не меняется давление.Так почему работа там совершается? Разве не A=pV ?
Не, не так. Давайте разбираться.
Будем выводить формулу, по которой можно посчитать работу совершенную газом. Когда газ работает? Когда он что-то перемешает. Для этого должен как-то меняться его объем. Например, газ расширяется и толкает поршень вверх, а с ним и какой-то груз, вот Вам и работа. То есть без изменения объема нет работы.
Чтобы вывести формулу, рассмотрим модельную задачу. Рассмотрим цилиндрический сосуд с газом. Пусть сосуд закрыт подвижным поршнем площади . Давление газа равно
. Определим, какую работу совершит газ, когда поршень сдвинется на малое расстояние
. Так как это работа на малом перемещении, то назовем ее элементарной работой и обозначим через
. Работа газа равна произведению силы, с которой он давит на поршень, на перемещение поршня (газ давит нормально, поэтому косинуса не возникает):
. Но сила, с которой газ давит на поршень связана с давлением газа соотношением:
. Если перемещение поршня мало, то можно считать, что давление газа не изменяется сильно и что оно остается постоянным. Тогда:
. Но
— это как раз изменение объема газа
. Окончательно имеем:
.
Получив эту формулу, можно забыть о том, как она выводилась (про сосуд и поршень), она оказывается верной для любого малого изменения объема.
Теперь, чтобы найти работу на конечном изменении объема нужно просуммировать работы по малым изменения, в математике это делается при помощи интеграла: Если внимательно приглядеться, то тут можно как раз увидеть площадь под линией процесса на диаграмме
. Вот почему говорят, что для поиска работы надо искать площадь под графиком на этой диаграмме.
Для частных случаев формула приобретает вид:
1) при изобарном процессе давление выносится за знак интеграла и получаем:
2) при изохорном объем не изменяется, поэтому пределы интегрирования совпадают, интеграл равен нулю, работа равна нулю.
3) при изотермическом процессе, давление уже изменяется с объемом, поэтому надо добавить в рассмотрение уравнение Клапейрона-Менделеева: . Следовательно,
. А значит работа при изотермическом процессе равна: