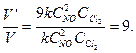1. Записать математическое выражение закона действующих масс для гомогенной реакции:
2. Как изменится скорость химической реакции:
если концентрацию первого реагирующего вещества увеличить в 3 раза?
Решение: до изменения условий скорость данной химической реакции выражалась уравнением
V = k · СNO 2 ·СCl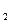
Концентрации веществ и скорость химической реакции при изменении условий выделим штрихом ( ‘ ). При изменении условий: С’NO = 3· СNO, тогда
V’ = k ·(С’NO) 2 · СCl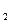
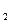
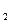
Найдем, во сколько раз изменилась скорость химической реакции при увеличении концентрации первого реагирующего вещества в 3 раза:
Ответ: скорость химической реакции увеличится в 9 раз.
3. Как изменится скорость химической реакции:
если давление в системе уменьшить в 2 раза?
Решение: до изменения условий (уменьшение давления) скорость данной гетерогенной химической реакции выражалась уравнением
V = k · (СO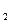
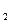
После уменьшения давления в системе в 2 раза парциальное давление кислорода, как и его молярная концентрация, также уменьшается в 2 раза: Р’O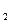
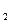
V’ = k · (Р’O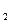
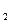
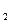
Ответ: скорость химической реакции уменьшится в 8 раз.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9469 — 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Пример 1. Написать выражения закона действия масс для реакций:
Решение. а) V =k×C 2 NO × 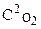
б) поскольку оксид железа (II) находится в твердом состоянии, его концентрация в ходе реакции не меняется и выражение для скорости данной гетерогенной реакции будет следующим: V = k× CCO.
Пример 2. Как изменяется скорость реакции образования аммиака N2(Г)+3H2(Г)=2NH3(Г) при уменьшении объема реакционного сосуда в 5 раз?
Решение. До изменения объема системы скорость реакции выражалась уравнением V = k× 

V’= k×5 



Сравнивая выражения для V и V’, находим, что скорость реакции возрастёт в 625 раз.

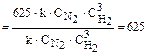
Пример 3. Температурный коэффициент реакции равен 3. Найдите, во сколько раз увеличится скорость этой реакции при увеличении температуры на 30 градусов.
Решение. По правилу Вант-Гоффа 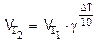
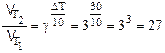
Таким образом, при повышении температуры на 30 градусов скорость ее возросла в 27 раз.
Пример 4. В момент установления равновесия в системе

равновесные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8 и 3,6 моль/л. Вычислите константу химического равновесия этой реакции (КС) и начальные концентрации азота и водорода (С0).
Решение. Вычислим константу равновесия
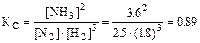
Из уравнения реакции следует, что на образование 2 моль NH3 расходуется 1 моль N2. Следовательно, на образование 3,6 моль NH3 необходимо 3,6:2=1,8 моль N2 (убыль N2 в ходе реакции). Отсюда

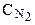
Аналогично рассматриваем начальную концентрацию H2: на образование 2 моль NH3 расходуется 3 моль Н2, а для получения 3,6 моль NH3 требуется 3,6×3/2=5,4 моль Н2 (убыль Н2 в реакции).

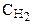
Таким образом, реакция начиналась при исходных концентрациях азота и водорода: 4,3 моль/л и 7,2 моль/л соответственно.
Пример 5. Как повлияет повышение концентраций исходных веществ и понижение температуры и давления на равновесие реакции


Решение. Согласно принципу Ле-Шателье, увеличение концентрации СО и Н2О приведет к смещению равновесия в сторону реакции, уменьшающей концентрации этих веществ, т.е. равновесие смещается вправо, в сторону прямой реакции. Из термохимического уравнения реакции видно, что прямая реакция является экзотермической (DН
Из уравнения реакции видно, что реакция проходит в газовой фазе без изменения числа частиц газообразных веществ (вступают в реакцию 2 частицы и образуются 2 частицы). Поэтому понижение давления не приведет к смещению химического равновесия данной реакции.
Контрольные вопросы
126. Во сколько раз изменится скорость реакции 2А+В=А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? Ответ: возрастет в 2 раза.
127. В начальный момент протекания реакции N2+3H2=2NH3 концентрации были равны: 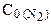
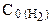
128.Начальные концентрации веществ в реакции

были равны: С0(СО)=0,5моль/л; 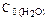
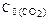
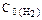
129.Через некоторое время после начала реакции

концентрации веществ составили: СА=3 моль/л; СВ=1моль/л, СС=0,8 моль/л. Каковы начальные концентрации веществ А и В? Ответ: 4,2 моль/л и 1,4моль/л.
130. 
концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию Сl2 – от 0,2 до 0,6 моль/л. Во сколько раз возросла скорость прямой реакции? Ответ: в 12 раз.
131. 
равна 0,6 л 2 /(моль 2 ×с). Начальные концентрации: С0(А)=2,0 моль/л; С0(В)=2,5 моль/л. В результате реакции концентрация вещества В оказалась равна 0,5 моль/л. Найдите концентрацию вещества А и скорость реакции. Ответ: 1,0 моль/л; 0,15 моль/(л×с).
132.Во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 °C до 80 °C. Температурный коэффициент скорости реакции равен 3. Ответ: в 81 раз.
133. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возросла в 15,625 раза? Ответ: 2,5.
134.При 150 °C реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить ее при: а) 200 °C; б) 80 °C. Ответ: а) 9,8 с; б) 162,76 ч.
135. 

4HCl+O2 2Н2О+2Сl2 концентрации ее участников стали равны: СHCl=0,85 моль/л; 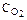
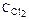
137. Вычислите, при какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2. Ответ: 304,9 К.
138. При некоторой температуре равновесие в системе

установилось при следующих концентрациях: [NO2]=0,06 моль/л, [NO]=0,24 моль/л, [O2]=0,12 моль/л. Найти константу равновесия этой реакции и начальную концентрацию NO2. Ответ: 1,92; 0,3 моль/л.
139.При 713 К константа диссоциации HI равна 1/64. Найти концентрации Н2, I2 и НI в состоянии равновесия, если вначале было взято 2 моль НI. Объем реакционного сосуда равен 5 л. Ответ: 0,04 моль/л; 0,04 моль/л; 0,032 моль/л.
140. 
141.Константа равновесия реакции

при некоторой температуре равна 0,5. Найдите равновесные концентрации CO и CO2 , если их начальные концентрации были равны: C0(CO) = 0,05 моль/л; 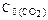
142. 
Ответ: 62,5 %.
143.Реакция протекает по уравнению 2A B. Начальная концентрация вещества A равна 0,2 моль/л. Константа равновесия реакции
KC=0,5. Определите равновесные концентрации веществ A и B.
Ответ: 0,170 моль/л; 0,015 моль/л.
144.Почему при изменении давления смещается равновесие системы

и не смещается равновесие системы

Ответ мотивируйте на основании расчета скоростей прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из систем.


146. Как повлияет на равновесие реакций


а) повышение давления; б) повышение температуры?
147. Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции

148.При состоянии равновесия в гомогенной системе

концентрации веществ были равны: [N2] = 0,3 моль/л; [H2] = 0,9 моль/л; [NH3] = 0,4 моль/л. Рассчитайте, как изменятся скорости прямой и обратной реакции, если увеличить давление в системе в 5 раз. В каком направлении сместится равновесие? Ответ: увеличатся в 625 раз и в 25 раз; вправо.
149. В каком направлении будет смещаться равновесие при повышении температуры и давления для следующих обратимых реакций:



150.Химическое равновесие гомогенной реакции

установилось при концентрациях участвующих в реакции веществ: [COCl2] = 10 моль/л; [CO] = 2 моль/л; [Cl2] = 4 моль/л. В равновесную систему добавили хлор в количестве 4 моль/л. Определите новые равновесные концентрации реагирующих веществ после смещения равновесия. Ответ: 10,8 моль/л; 1,2 моль/л; 7,2 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10582 — 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Ответ
Проверено экспертом
1) C(T) + CO2 = 2CO; выр-ие з. дейст-х масс для ПРЯМОЙ р-ии: v = k*[CO2], для ОБРАТНОЙ р-ии: v = k*[CO]^2;
2) 2NO2 = N2O4; при условии, что и NO2 и N2O4 — газы, выр-ие з. дейст-х масс для ПРЯМОЙ р-ии: v = k*[NO2]^2, для ОБРАТНОЙ р-ии: v = k*[N2O4];
3) 2H2 + O2 = 2H2O; опять же, при условии, что и реагенты и продукты — газы, выр-ие з. дейст-х масс для ПРЯМОЙ р-ии: v = k*[H2]^2*[O2], для ОБРАТНОЙ р-ии: v = k*[H2O]^2.